1. Teori Tumbukan
Menurut teori, sebelum bereaksi partikel-partikel zat pereaksi akan
mengalami tumbukan. Tidak semua tumbukan berhasil membentuk zat hasil
reaksi. Tumbukan yang baik adalah yang mampu menghasilkan energi. Energi
hasil tumbukan itulah yang digunakan untuk merenggangkan atau
memutuskan ikatan atom-atom dalam zat pereaksi pada awal proses reaksi
kimia. Selanjutnya energi ini disebut energi aktivasi, yaitu energi
minimum yang diperlukan oleh zat-zat pereaksi untuk membentuk zat hasil
reaksi.
Tumbukan dengan posisi yang benar dan salah dapat ditunjukkan dengan gambar berikut.
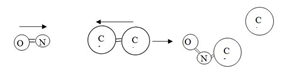
dalam reaksi NO+Cl2 → NOCl+ Cl
2. Teori Keadaan Transisi
Menurut teori ini, sebelum bereaksi zat pereaksi bergerak saling mendekat kemudian berinteraksi membentuk kompleks molekul. Selama berinteraksi terjadi transformasi bentuk dari energi kinetik ke energi potensial. Energi tersebut diserap oleh kompleks molekul untuk membentuk energi potensial tinggi yang mudah bereaksi menghasilkan zat hasil reaksi. Kompleks molekul yang berenergi tinggi dan tidak stabil ini disebut kompleks molekul teraktivasi atau kompleks molekul yang berenergi tinggi.
Berdasarkan teori keadaan transisi, reaksi kimia dapat dilihat sebagai dua tahap. Tahap pertama perubahan pereaksi menjadi keadaan transisi, dan tahap kedua merupakan perubahan keadaan transisi membentuk zat produk. Untuk lebih jelasnya dapat digambarkan sebagai berikut.
Tahap 1. Pembentukan keadaan transisi dari pereaksi
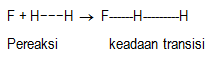
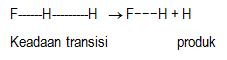
Suatu reaksi kimia akan dapat berlangsung bila antar zat pereaksi saling mendekat dan kemudian melakukan tumbukan. Tumbukan yang menghasilkan reaksi kimia ditentukan oleh:
a. jumlah energi minimumnya (energi aktivasi) dapat terlewati; dan
b. posisi yang tepat dalam melakukan tumbukannya.
Semakin cepat/banyak tumbukan yang terjadi maka reaksi kimia akan cepat berlangsung, dengan kata lain, semakin cepat tumbukan laju reaksi makin cepat pula.
4. Faktor-faktor yang mempengaruhi Jumlah Tumbukan
a. Pengaruh suhu
Bila suhu dinaikkan, energi kinetik zat pereaksi akan meningkat sehingga tumbukan yang terjadi juga akan semakin banyak. Peningkatan suhu ini juga dapat memicu terbentuknya energi yang lebih besar dari energi aktivasi reaksi. Untuk lebih jelasnya dapat dilihat pada gambar berikut kurva fraksi molekul terhadap energi kinetik pada suhu T1 yang lebih kecil dari T2 sebagai berikut:
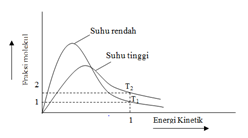
Laju reaksi umumya berubah 2 kali cepat untuk tiap kenaikan suhu 10 .
Pengaruh suhu terhadap laju reaksi dapat dirumuskan sebagai berikut:
Semakin tinggi konsentrasi suatu zat, maka jumlah partikelnya akan semakin banyak, akibatnya jumlah tumbukan persatuan waktu juga akan semakin banyak. Misal dalam suatu ruangan terdapat sejumlah partikel A dan B maka jumlah tumbukan antara partikel A dan partikel B dalam satu satuan waktu adalah satu kali. Jika pada suhu tetap dan jumlah partikel A juga tetap sedangkan jumlah partikel B dibuat menjadi 2x jumlah semula maka jumlah tumbukan persatuan waktu menjadi 2x semula. Jika jumlah partikel A dan B masing-masing diubah menjadi 2x semula maka jumlah tumbukan persatuan waktu menjadi 4x dari semula. Jadi jumlah tumbukan antara partikel A dan B sebanding dengan jumlah partikel A kali jumlah partikel B.
Bila jumlah molekul A dan B dinyatakan dalam bentuk konsentrasinya, maka:
jumlah tumbukan persatuan waktu = [A][B], dimana [A] adalah konsentrasi A dan [B] adalah konsentrasi B.
Bila molekul-molekul yang bertumbukan itu ada tiga jenis, misal A, B dan C, maka:
jumlah tumbukan persatuan waktu = v = k[A][B][C], dimana v = laju tumbukan, k = tetapan laju tumbukan.
c. Pengaruh Luas Permukaan Sentuhan
Bila luas permukaan partikel pereaksi besar, maka bagian yang mampu bertumbukan juga akan semakin luas pula. Hal tersebut tentu saja membuat jumlah tumbukan yang terjadi akan semakin banyak.
d. Pengaruh Katalis
Katalis adalah senyawa pemercepat reaksi yang mampu terbentuk kembali di akhir reaksi. Dengan kata lain, selama mempercepat proses reaksi, katalis tidak ikut bereaksi. Dalam hal ini, katalis berperan menurunkan energi aktivasi. Katalis dapat mengubah langkah-langkah reaksi dari yang berenergi aktivasi tinggi ke energi aktivasi rendah. Bila dalam campuran zat pereaksi diberi katalisator maka jumlah tabrakan antarpartikel pereaksi akan menghasilkan energi yang lebih besar dari energi aktivasi reaksi.












Teori Tumbukan ~ Impian Kita >>>>> Download Now
BalasHapus>>>>> Download Full
Teori Tumbukan ~ Impian Kita >>>>> Download LINK
>>>>> Download Now
Teori Tumbukan ~ Impian Kita >>>>> Download Full
>>>>> Download LINK