Tempe merupakan makanan khas Indonesia yang dibuat dari bahan dasar
kedelai yang difermentasikan menggunakan ragi. Biasanya tempe yang baru
dibuka bungkusnya terasa hangat. Pernahkah kalian berpikir reaksi apakah
yang terjadi sehingga membuat tempe tersebut terasa hangat? Reaksi
itulah yang kita kenal sebagai reaksi eksoterm. Dalam topik ini, kita
akan membahas reaksi eksoterm tersebut. Selain itu, kita juga akan
membahas reaksi endoterm dan perubahan entalpi
.
A. Sistem dan Lingkungan
Reaksi kimia ketika terjadi dalam suatu wadah yang terbuka, pada umumnya
akan mengalami pertambahan energi atau kehilangan energi dalam bentuk
panas. Pada proses ini, energi panas berpindah dari sistem ke lingkungan
atau sebaliknya. Sistem adalah segala sesuatu yang dipelajari perubahan
energinya, sedangkan lingkungan adalah segala sesuatu yang berada di
sekeliling sistem.
Dalam ilmu kimia, sistem adalah sejumlah zat yang bereaksi, sedangkan
lingkungan adalah segala sesuatu di luar zat-zat tersebut. Misalnya
dalam tabung reaksi yang berisi air dilarutkan urea padat, ternyata pada
tabung reaksi terasa dingin. Sistem pada reaksi ini adalah air dan
urea, sedangkan yang termasuk lingkungan adalah tabung reaksi.
B. Perubahan Entalpi
Energi yang terkandung di dalam suatu sistem atau zat disebut entalpi
(H). Entalpi suatu sistem tidak dapat diukur, yang dapat diukur adalah
perubahan entalpi yang menyertai perubahan zat. Oleh karena itu, kita
dapat menentukan entalpi yang dilepaskan atau diserap pada saat terjadi
reaksi.
Perubahan energi pada suatu reaksi yang berlangsung pada tekanan tetap
disebut perubahan entalpi. Perubahan entalpi dinyatakan dengan lambang
∆H, dengan satuan Joule dan kilo Joule.
Contoh:
Entalpi air ditulis HH2O. Air dapat berwujud cair dan padat. Entalpi yang dimilikinya berbeda, HH2O(l) lebih besar daripada HH2O(s).
Oleh karena itu, untuk mengubah es menjadi air diperlukan energi dari
lingkungan. Harga ∆H pada peristiwa perubahan es menjadi air adalah ∆H =
HH2O(l) – HH2O(s).
Perubahan ini dapat ditulis dalam suatu persamaan reaksi yang disebut persamaan termokimia sebagai berikut.
H2O(s) → H2O(l) ∆H = +6,02 kJ
Berdasarkan perubahan entalpi, dikenal dua macam reaksi yaitu reaksi eksoterm dan reaksi endoterm.
C. Reaksi Eksoterm dan Endoterm
Jika suatu reaksi yang terjadi dalam sistem menghasilkan panas, maka
terasa panas bila sistem disentuh. Panas dihasilkan dari zat-zat
bereaksi yang merupakan sistem, kemudian dilepaskan ke lingkungan.
Reaksi ini termasuk reaksi eksoterm.
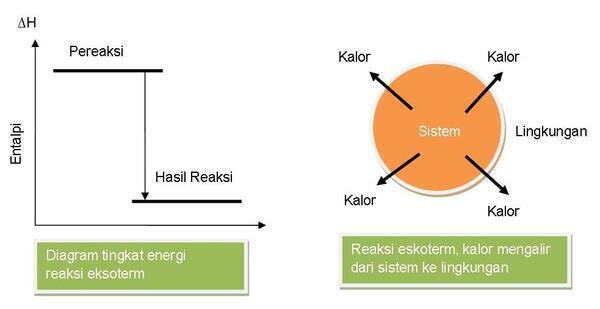
Pada reaksi eksoterm, energi panas atau kalor berpindah dari sistem ke
lingkungan. Entalpi sistem sebelum reaksi lebih besar daripada sesudah
reaksi atau Hpereaksi > Hhasil reaksi, sehingga perubahan entalpi sistem bernilai negatif (∆H = - ).
Contohnya, jika kamu memasukkan bongkahan batu kapur ke dalam air, maka
dalam air akan terjadi gelembung-gelembung gas. Kalau kita pegang, wadah
reaksinya akan terasa panas.
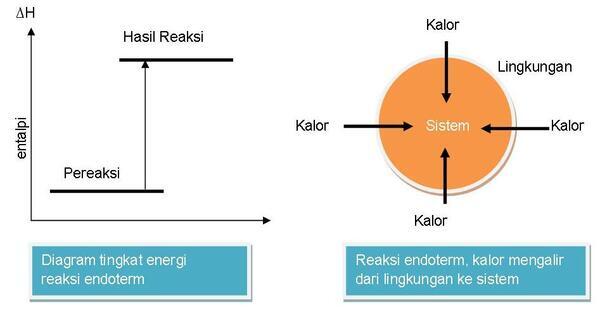
Contohnya pada reaksi antara barium hidroksida dan ammonium klorida. Kalau kita pegang wadah akan terasa dingin karena adanya aliran kalor dari lingkungan ke sistem.












sangat membantu:)
BalasHapusBagus sekali.. kalau urea d dlm tabung tdk di beri air apakah dingin juga.dan apakah hawa dingin tsb bisa menyusut dlm jangka lama.?
BalasHapusReaksi Eksoterm Dan Endoterm ~ Impian Kita >>>>> Download Now
BalasHapus>>>>> Download Full
Reaksi Eksoterm Dan Endoterm ~ Impian Kita >>>>> Download LINK
>>>>> Download Now
Reaksi Eksoterm Dan Endoterm ~ Impian Kita >>>>> Download Full
>>>>> Download LINK